Содержание:
Испарение веществ в разреженной среде. Часть 2
Если бы над поверхностью вещества поддерживался абсолютный вакуум, то скорость испарения определялась бы только той скоростью, с которой молекулы удаляются от поверхности испарения, т. е. скоростью их теплового движения. Иначе говоря, в случае малых давлений пара скорость испарения практически не зависит от наличия или отсутствия обратного потока частиц, т. е. не зависит от присутствии пара над конденсированной фазой. Испарившиеся молекулы почти не- возвращаются обратно к поверхности испарения. Тогда, используя законы кинетической теории газов, можно получить формулу для определения скорости испарения льда с открытой поверхности в вакуум (аналогично конденсации паров воды ниже тройной точки).
В условиях высокого вакуума масса передается от поверхности испарения к поверхности конденсации без промежуточных столкновений. В рассматриваемом объеме молекулы практически не сталкиваются между собой. Число же столкновений молекул со стенкой остается очень большим. Это значит, что процесс тепло- и массообмена в высоком вакууме определяется только взаимо-1 действием молекул пара со стенками аппарата. Если отсутствует передача тепла теплопроводностью, то сублимируемое вещество в высоком вакууме получает энергию от молекул, возвращающихся к поверхности испарения после отражения от стенок аппарата с высокой температурой или от источника | элементарных частиц с высокой энергией.
Кнудсен, рассмотрев механизм отражения молекул от стенки, пришел к заключению, что молекулы газа, попадая на поверхность твердого тела, задерживаются на ней силами сцепления и образуют адсорбированный слой. В адсорбированном состоянии молекулы находятся столько времени, необходимо для «полного» обмена энергией между молекулами твердого тела и адсорбированными молекулами. После этого под влиянием собственной) теплового движения и теплового движения молекул твердого тела они покидают стенку. Время пребывания адсорбированной молекулы на поверхности твердого тела определяется разностью энергий молекул. Чем больше эта разность, тем дольше адсорбированная молекула находится на поверхности твердого тела, и наоборот, чем меньше энергетическая разность, тем быстра она покинет твердое тело. Таким образом, происходит перенос энергия
от стенки аппарата с большей энергией к поверхности с меньшей энергией.
В результате соударения с поверхностью молекулы с большей энергией ослабляется взаимосвязь между молекулами на поверхности испарения, и ее покидают те частицы, которые уже не удерживаются силами взаимосвязи. При этом «возвращенная» молекула может остаться на поверхности испарения, но вместо нее с поверхности вылетит несколько других молекул или комплексов в зависимости от анергии «возвращенной» молекулы. Не исключена также возможность вылета частиц с поверхности испарения вместе с «возвращенной» молекулой.
Рассматриваемый процесс продолжается в том случае, если избыток молекул пара отводится из камеры испарения. Если такого отвода нет, то процесс испарения постепенно замедлится и затем прекратится.
Справочник химика 21
Химия и химическая технология
Закон испарения жидкости со свободной
В 1803 г. Дальтоном был установлен количественный закон испарения жидкости со свободной поверхности (для установившегося режима), аналитическое выражение которого имеет вид . [c.113]
Чтобы определить скорость испарения вещества из смеси, пользуются формулами, предложенными для вычисления скорости испарения жидкости со свободной поверхности. На основании приближенного закона Дальтона количество жидкости О, испарившейся со свободной поверхности, можно определить по формуле [c.54]
Этот основной закон испарения жидкости со свободной поверхности был предложен в 1853 г. Дальтоном и подтвержден многими позднейшими исследованиями. Математически его выражают так [c.400]
Полученное уравнение является основным законом испарения жидкости со свободной поверхности, предложенным в 1803 г. Дальтоном и подтвержденным многими позднейшими исследованиями. [c.539]
Как указано выше, в процессе сушки различают два периода, которые характеризуются постоянной (первый период) и падающей (второй период) скоростью сушки. В первом периоде, когда удаляется поверхностная влага, процесс аналогичен испарению со свободной поверхности жидкости и подчиняется закону Дальтона, который можно представить в виде [c.279]
В этой области процесс удаления влаги из материала в первом периоде аналогичен процессу испарения жидкости со свободной поверхности. Тепло подводится к поверхности парообразования от греющей поверхности через слой материала, не охваченный процессом массообмена, поэтому количество переданного материалу тепла в этом случае определяется с достаточной степенью точности законом теплопроводности Фурье. [c.285]
Влияние скорости воздуха. С некоторым приближением можно считать, что процесс испарения влаги из материала в периоде постоянной скорости сушки идентичен с процессом исиарения жидкости со свободной поверхности. Закон Дальтона для скорости испарения жидкости со свободной поверхности имеет следующий вид [c.449]
В период постоянной скорости влажность материала больше гигроскопической, пар у его поверхности является насыщенным (р = р ) и соответствует температуре мокрого термометра t . В этот период происходит интенсивное поступление влаги из внутренних слоев материала к его поверхности. Скорость поверхностного испарения влаги из материала может быть принята равной скорости испарения ее со свободной поверхности жидкости и определена, согласно закону Дальтона. Поэтому уравнение влагоотдачи с поверхности материала имеет вид [c.610]
Из сравнения адсорбционного равновесия с равновесием твердого тела или жидкости с паром видно следующее [134] испарение и конденсация насыщенного пара происходят по всей поверхности жидкости или твердого тела, при адсорбционном равновесии адсорбция происходит только на свободной части поверхности, а десорбция — лишь с занятой части поверхности при 0 = /2 обе части поверхности равны и оба вида равновесия сходны. Этим сходством оправдано именование величины Ь как упругости десорбции, по аналогии с упругостью насыщенного пара. Поэтому для адсорбционного равновесия, аналогично закону Клаузиуса—Клапейрона [c.45]
Было установлено, что отклонение величины для вязкости от адди- тивного значения равно ДР /2,45, где Д/ представляет собой избыточную свободную энергию смешения , являющуюся мерой отклонения от закона Рауля р ]. Интересно отметить, что здесь появляется то же самое число 2,45, которое равно отношению энергии испарения или работы, требующейся для образования дырки в жидкости, к свободной энергии активации вязкого течения. [c.493]
Когда чистая жидкость В находится в равновесии со своим паром, свободная энергия жидкого и парообразного вещества В должна быть одинаковой. Испарение и конденсация происходят с одинаковой скоростью. Если к жидкости добавляется небольшое количество нелет чего растворенного вещества А, свободная энергия или способность к испарению вещества В в растворе понижается, поскольку некоторая часть молекул раствора, достигающая поверхности раздела жидкости и газа, относится к веществу А, а не к В. Однако обратная тенденция, конденсация пара в жидкость, остается неизменной, потому что в паровой фазе отсутствуют молекулы типа А, которые могли бы помещать молекулам типа В конденсироваться. При постоянной температуре частота, с которой молекула жидкости достигает поверхности с достаточной кинетической энергией, чтобы перейти в паровую фазу, одинакова в чистом веществе Вив растворе, если считать, что раствор обладает идеальными свойствами (рис. 18-11). Однако предполагается, что растворенное вещество А является нелетучим. Поэтому не все молекулы, достигающие поверхности с указанной энергией, могут на самом деле покинуть жидкость. Если 1% молекул в растворе принадлежит к типу А, то давление пара В составит лишь 99% давления пара чистого вещества В. Это утверждение основано на законе Рауля [c.139]
Смотреть страницы где упоминается термин Закон испарения жидкости со свободной: [c.78] [c.48] [c.236] [c.308] [c.62] Основные процессы и аппараты химической технологии Издание 4 (низкое качество) (1948) — [ c.0 ]
ВРЕВСКОГО ЗАКОНЫ
ВРЕВСКОГО ЗАКОНЫ, описывают зависимость состава равновесных жидкой и паровой фаз двойных систем от т-ры (давления). Основываются на общих термодинамич. соотношениях, устанавливающих условия равновесия в двухфазных системах, частным случаем к-рых является равновесие жидкость — пар. При выводе Вревского законов сделан ряд допущений, в частности предполагается, что поведение газовой фазы близко к поведению идеального газа. Поэтому Вревского законы справедливы только для области т-р и давлений, значительно удаленной от критич. точки равновесия жидкость — пар в данной системе.
Первый Вревского закон: при данном составе жидкой фазы равновесная с ней газовая фаза с увеличением т-ры (давления) обогащается тем компонентом, для к-рого больше парциальная мольная теплота испарения. Приближенно вместо парциальной мольной теплоты испарения данного компонента можно использовать теплоту испарения чистого в-ва. Второй Вревского закон: в азеотропной смеси с максимумом на изотерме зависимости общего давления от состава (минимумом на изобаре т-р кипения) при повышении т-ры (давления) возрастает концентрация компонента с большей парциальной мольной теплотой испарения. В азеотропной смеси с минимумом общего давления (максимумом т-ры кипения) при повышении т-ры (давления) возрастает концентрация компонента с меньшей парциальной мольной теплотой испарения. Этот закон особенно важен при разработке процессов азеотропной ректификации.
Третий Вревского закон: при изменении т-ры в системах, для к-рых на кривой зависимости общего давления от состава имеется максимум (на кривой т-р кипения — минимум), состав пара, находящегося в равновесии с р-ром постоянного состава, и состав азеотропной смеси изменяются в одном направлении (вдоль линий АВ и LM на рис. а); если же кривая общего давления имеет минимум (кривая т-р кипения — максимум), то при изменении т-ры состав пара, находящегося в равновесии с р-ром постоянного состава, и состав азеотропной смеси изменяются в противоположных направлениях (вдоль линий АВ и LM на рис. б).
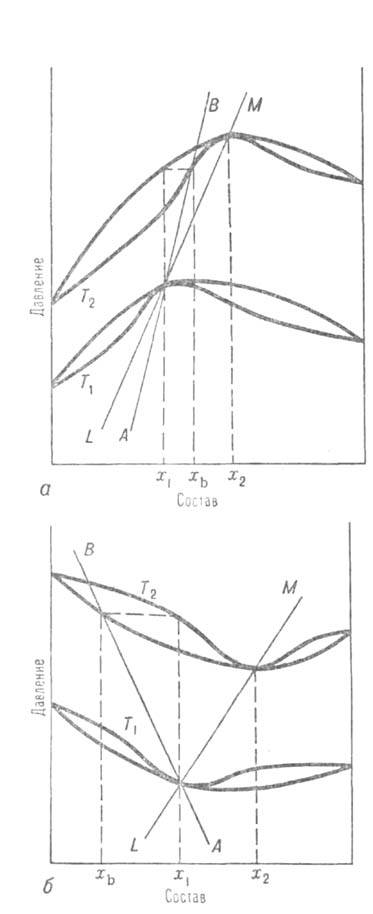
Диаграмма равновесия жидкость — пар для двойных систем с положит. (а) и отрицат. (б) азеотропами; Т1 и Т2 — т-ры, х1 и х2 -составы, соответствующие азеотропным смесям, xb— состав пара при Т2, равновесного жилкой смеси состава x1. Линия AВ-изменение состава пара с т-рой, линия LM — изменен не состава азеотропа с т-рой.
Законы были сформулированы М.С. Вревским в 1911 на основе эксперим. исследований и широко используются при разработке процессов разделения жидких смесей и очистки в-в.
===
Исп. литература для статьи «ВРЕВСКОГО ЗАКОНЫ»: Вревский М.С, Работы по теории растворов. М.-Л., 1953; Коган В. Б., Гетерогенные равновесия, Л., 1968, с. 114-26; Хазанова Н. Е., Системы с азеотропизмом при высоких давлениях, М., 1978. Н. Е. Хазанова.
Страница «ВРЕВСКОГО ЗАКОНЫ» подготовлена по материалам химической энциклопедии.
Законы испарения


3.4. Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом . Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры T кр . Например, для воды критическая температура равна 647,3 К , для азота 126 К , для кислорода 154,3 К . При комнатной температуре ( ≈ 300 К ) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия , когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной . Пар, находящийся в равновесии со своей жидкостью, называют насыщенным .
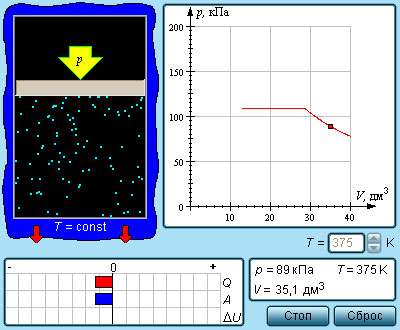
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p 0 данного вещества зависит только от его температуры и не зависит от объема . Поэтому изотермы реальных газов на плоскости ( p , V ) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
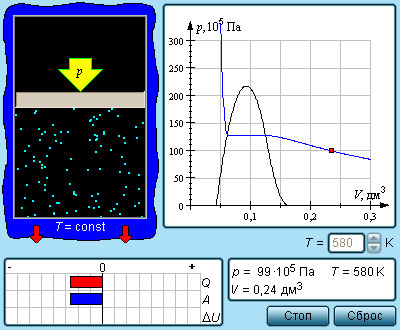
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре T кр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > T кр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p , которое, как правило, меньше давления насыщенного пара p 0 . Отношение p / p 0 , выраженное в процентах, называется относительной влажностью воздуха.
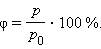
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (10 6 –10 7 ) Па ), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p 0 насыщенного пара определяется по кривой равновесия p 0( T ) для данного вещества.
Давление p 0 насыщенного пара очень быстро возрастает с ростом температуры T . Зависимость p 0 ( T ) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением . Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению .
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С . Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм . При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм , и температура кипения понижается до 70 °С .
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p 0 ( T ) можно определять температуру кипения жидкости при различных давлениях.
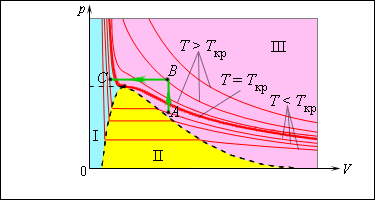
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия . Примером может служить кривая равновесия p 0 ( T ) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости ( p , T ), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе ( p , T ) кривые равновесия называются фазовой диаграммой .
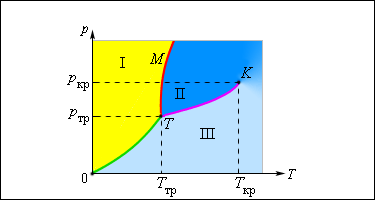
Кривая 0 T , соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации . Кривая TK равновесия между жидкостью и паром называется кривой испарения , она обрывается в критической точке K . Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления .
Кривые равновесия сходятся в точке T , в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой .
Для многих веществ давление p тр в тройной точке меньше 1 атм ≈ 10 5 Па . Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты T тр = 273,16 К , p тр = 6,02·10 2 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина (см. §3.2). Существуют, однако, и такие вещества, у которых p тр превышает 1 атм . Так для углекислоты (CO2) давление p тр = 5,11 атм и температура T тр = 216,5 К . Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С . Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
Испарение и конденсация
Как известно, жидкости могут испаряться, переходя в газообразное состояние. Процесс парообразования может происходить из свободной поверхности жидкости или внутри ее объема, при кипении. Он происходит вследствие поглощения определенного количества теплоты:
где r — удельная теплота парообразования, которая зависит от рода вещества, m — его масса.
Удельная теплота парообразования измеряется в Дж/кг. Численно она равна количеству теплоты для превращения 1 кг жидкости в пар при определенной температуре. Как правило, ее значение указывают для температуры кипения.
В природе происходит и обратный процесс — превращение пара в жидкость. Он называется конденсацией. Вследствие конденсации пара жидкость получает такое же количество теплоты, которое необходимо для ее испарения при той же температуре.

Испарение жидкостей происходит потому, что некоторые молекулы жидкости имеют кинетическую энергию, достаточную для преодоления сил притяжения между ними. Чем выше температура жидкости, тем большее количество таких молекул. При определенных условиях эти молекулы вылетают из свободной поверхности жидкости (рис. 3.1) и могут навсегда ее покинуть (испарение) или вернуться обратно (конденсация). Материал с сайта http://worldofschool.ru
Испарение наблюдается также и у твердых тел. Этот процесс называется сублимацией.
Интенсивность испарения жидкостей зависит от многих факторов — рода вещества (бензин быстрее испаряется, нежели вода), температуры и площади свободной поверхности жидкости (чем она больше, тем большее количество молекул вылетает из нее), внешних условий (ветер, давление, плотность пара).
